
|
F0はa,b,cの3種類のサブユニットからなり(a:b:c=1:2:10)、一方、F1はα,β,γ,δ,ε(α:β:γ:δ:ε=3:3:1:1:1)からなる。F0F1−ATP酵素のF1を構成するサブユニットのうちαとβサブユニットにはそれぞれ1ケ所ずつヌクレオチド結合部位があり、このうち3ケ所の結合部位でヌクレオチドの交換反応が起こる。これらの内、ATPの加水分解反応にしたがって3ケ所の結合部位で非常に速やかなヌクレオチドの交換反応が起きることから、この3ケ所がFlの真の接触部位と考えられている。 このF1については1994年に結晶のX線解析が発表されその詳細な分子構造が明らかになった。それによるとαとβは交互にドーナツ状に配列しており、その中央部にγが入り込んでいる。そのγを中心軸としてα3β3が回転することによってエネルギーの変換を行っているものと考えられている。 なお、AT合成酵素はATP加水分解のエネルギーを使い、ミトコンドリア内膜を介してプロトンをくみ出すこともできるし、電気化学的勾配により流入するプロトンを使ってATPを合成することもできる。 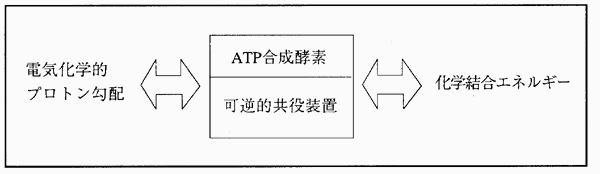
図4−15 可逆共役装置としてのATPアーゼ
前ページ 目次へ 次ページ
|

|